Szanowni Państwo,
w porozumieniu z Europejską Agencją Leków i Urzędem Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych pragniemy przekazać następujące informacje:
PODSUMOWANIE
- Zgłaszano przypadki błędów dawkowania z poważnymi następstwami, w tym zgodny, gdy metotreksat przeznaczony do stosowania jeden raz w tygodniu w leczeniu chorób zapalnych, był stosowant codziennie.
- Produkty lecznicze zawierające metotreksat powinny być przepisywane wyłącznie przez lekarzy z doświadczeniem w ich stosowaniu.
- Fachowy personel medyczny przepisujący lub wydający metroteksat do stosowania w leczeniu chorób zapalnych powinien
- Przekazać pacjentowi/opiekunowi wyczerpujące i jasne instrukcje dotyczące dawkowania jeden raz w tygodniu;
- Podczas wystawiania / realizowania każdej nowej recepty za każdym razem upewnić się, czy pacjent/opiekun rozumie, że lek należy stosować jeden raz w tygodniu;
- Poinformować pacjenta/opiekuna o objawach przedawkowania i wskazać, że w przypadku podejrzenia przedawkowania należy jak najszybciej zasięgnąć porady medycznej.
Informacje związane z bezpieczeństwem stosowania
Metroteksat jest dopuszczony do obrotu w UE dla dwóch różnych grup wskazań, przy czym każda z nich ma odmienny schemat dawkowania:
- W leczeniu nowowtorów, gdzie częstotliwość podawania zależy od schematy leczenia i może wymagać podawania metotreksatu codziennie;
- W leczeniu chorób zapalnych (w tym rumatoidalnego zapalenia stawów, łuszczycy i choroby Leśniewskiego-Crohna), w którym wymagane jest stosowanie metotreksatu jeden raz w tygodniu.
Pomimo podjętych do tej pory działań w cely zapobiegania błędom dawkowania, nadal odnotowywane są ciężkie, czasami śmiertelne przypadki, w których pacjenci leczeni z powodu choroby zapalnej przyjmowali metotreksat codziennie zamiast jeden raz w tygodniu. W przeglądzie danych dotyczących bezpieczeństwa prowadzonym w całej UE wykazano, że błędy te mogą wystąpi na każdym etapie procesu stosowania leku.
W związku z tym, wprowadzone zostaną dalsze działania mające na celu zapobieganie błędom dawkowania z uwzględnieniem zwiększenia widoczności ostrzeżeń na opakowaniach zewnętrznych i bezpośrednich oraz aktualizację charakterystyki produktu leczniczego i ulotki dla pacjenta, dołączonej do opakowania. Dla doustnych postaci leku dostępne będą materiały edukacyjne przeznaczone dla fachowego personelu medycznego oraz karta pacjenta, która będzie dołączona do każdego opakowania. Ponadto tabletki dostępne będą wyłącznie w blistrach.
Zgłaszanie działań niepożądanych
Przypadki podejrzeń wystąpienia działań niepożądanych w tym wszelkie błędy dawkowania należy zgłaszać za pośrednictwem krajowego systemu zgłaszania do Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C, 02-222 Warszawa, tel. +48 22 49 21 301, faks +48 22 49 21 309, e-mail: ndl@urpl.gov.pl.
Formularz zgłoszenia działania niepożądanego dostępny na stronie:
Lub bezpośrednio do podmiotów odpowiedziaknych wymienionych w Załączniku.
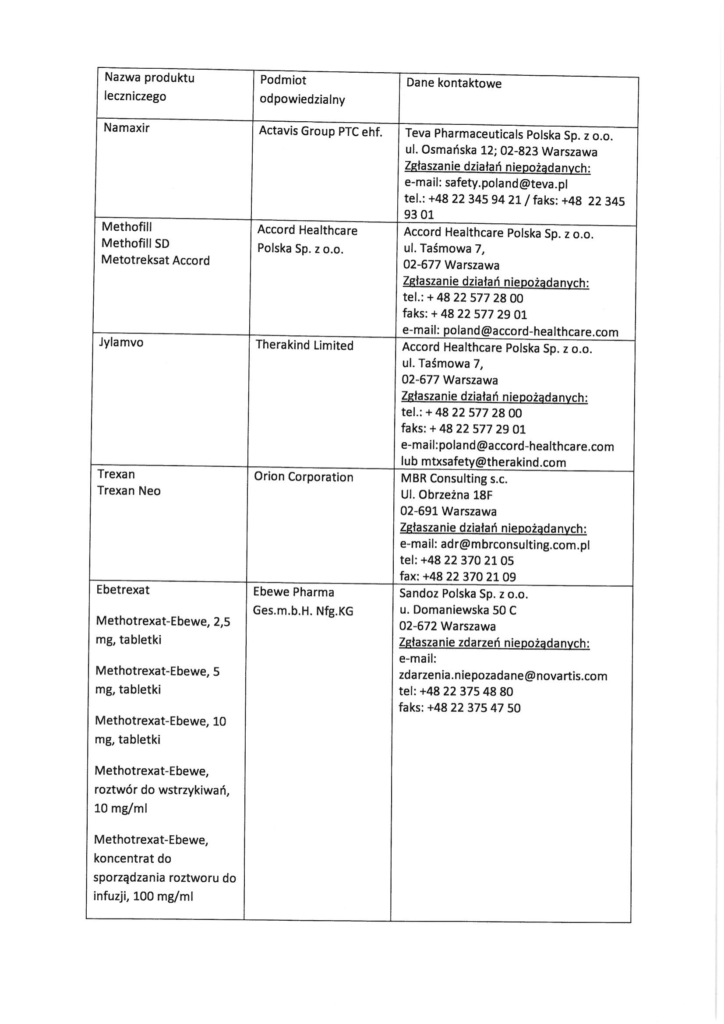
ZAŁĄCZNIK
Dane kontaktowe podmiotów odpowiedzialnych
Podejrzenie wystąpienia działań niepożądanych można również zgłaszać przedstawicielowi podmiotu odpowiedzialnego, korzystając z poniższych danych. W przypadku dalszych pytań lub potrzeby uzyskania dodatkowych informacji prosimy o kontakt z URPL.


Leave a reply