na podstawie rozporządzenie Ministra Zdrowia z 12 października 2018 r. w sprawie zapotrzebowań i wydawania z apteki produktów leczniczych, środków spożywczych specjalnego przeznaczania żywieniowego i wyrobów medycznych.
Dzielnie opakowań produktów leczniczych:
w związku z dużą ilością zapytań pragniemy przypomnieć, iż § 5 ust. 3 w/w rozporządzenia wskazuje zamknięty katalog produktów leczniczych, które mogą podlegać dzieleniu w procesie realizacji recepty i wydawania tych produktów z apteki.
Dzieleniu podlegają następujące grupy produktów leczniczych:
- Antybiotyki do stosowania wewnętrznego
- Produkty lecznicze przeznaczone do podawania pozajelitowego
- Leki do podawania wziewnego
- Leki posiadające kategorie dostępności Rpw (np. I-N i II-P)
- Leki zawierające substancje odurzające i psychotropowe z grup III-P, IV-P, II-N
Dzieleniu nie podlegają opakowania bezpośrednie, a wydanie zaordynowanej ilości podzielonych jednostek dawkowania wydaje się w ilości maksymalnie zbliżonej, ale nie większej aniżeli określona na recepcie. Wydawane opakowanie bezpośrednie musi zawierać nazwę produktu leczniczego, jego datę ważności i numer serii.
Podzielona część opakowania, jeżeli nie przyczyni się to do zmiany gwarantowanej jakości produktu, wydawana jest w opakowaniu własnym apteki, do którego dołącza się ulotkę leku lub jego kopię.
Zgodnie z brzmieniem przywołanego wyżej przepisu tylko te grupy produktów leczniczych mogą podlegać dzieleniu przy wydawaniu z apteki produktu leczniczego.
Wydanie leku w postaci innej aniżeli określona na recepcie:
§5 ust. 7 pkt 2 w/w rozporządzenia wprowadził możliwość wydania leku w postaci innej niż określona na recepcie, ale pod warunkiem, że takie wydanie nie wpłynie na bezpieczeństwo i skuteczność stosowania produktu leczniczego (nie powoduje różnic farmaceutycznych).
Wydanie inne postaci leku może nastąpić tylko za zgodą pacjenta lub osoby odbierającej lek, a osoba wydająca informuje, na piśmie, pacjenta lub osobę odbierającą lek o ewentualnej zmianie sposobu dawkowania. Takie wydanie musi zostać odnotowane w Dokumencie Realizacji Recepty w obszarze Adnotacje.
Wydanie leku w mocy niższej niż określona na recepcie:
Wydawanie produkt lecznicze w mocy niższej aniżeli zaordynowana reguluje § 5 ust. 7 pkt 1. w/w rozporządzenia.
Regulacja ta nieznacznie zmieniła obowiązującą od wielu zasadę wydawania leku w mocy niższej niż określona na recepcie. Umożliwiono wydanie, za zgodą osoby odbierającej lek, wydanie mocy niższej, lecz moc leku wydawanego nie musi być podzielna w stosunku do leku zapisanego na recepcie.
Nadal zachowano zasadę, iż całkowita ilość substancji czynnej w mocy wydanej musi odpowiadać ilości substancji zawartej w dawce zapisanej na recepcie.
Osoba wydająca produkt leczniczy zobowiązana jest do poinformowania na piśmie o zmienionym sposobie dawkowania osobę odbierająca lek. Zmianę taką odnotowuje się w Dokumencie Realizacji Recepty (Adnotacje).
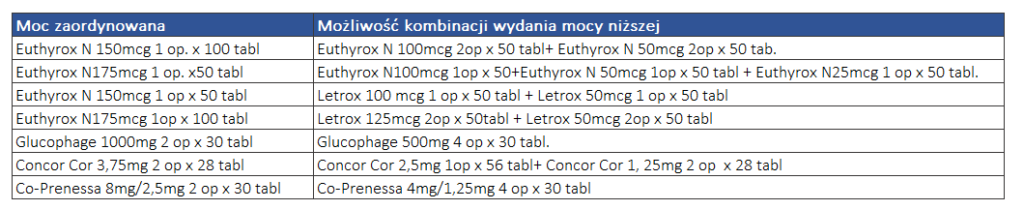
Przykłady wydania dawki niższej, wraz z zastosowaniem substytucji:
Opracował mgr farm. Marian Witkowski
Leave a reply
Leave a reply